
Reação Química
- Uma reação química ocorre quando certas substâncias sofrem transformações em relação ao seu estado inicial (reagentes). Para que isso possa acontecer, as ligações entre átomos e moléculas devem ser rompidas e devem ser restabelecidas de outra maneira. Como essas ligações podem ser muito fortes, geralmente é necessária energia na forma de calor para iniciar a reação.
A ocorrência de uma reação química é indicada pelo aparecimento de novas substâncias (produtos), diferentes das originais (reagentes). Quando as substâncias reagem, às vezes ocorrem fatos visíveis que confirmam a ocorrência da reação. Dentre eles, podemos destacar: desprendimento de gás e luz, mudança de coloração e cheiro, formação de precipitados, etc.
- Em certas situações, os reagentes se encontram com impurezas e as reações químicas não acontecem com aproveitamento total porque não ocorrem somente nos laboratórios, mas em toda a parte e a todo o momento. Oxidação e redução são exemplos desses tipos de reações que ocorrem em nosso dia a dia.
Quando dois reagentes são misturados e eles não se encontram em proporções iguais, um deles será consumido totalmente enquanto o outro poderá deixar certa quantidade sem reagir. O reagente que teve seu aproveitamento total é chamado de reagente limitante e o outro será o reagente em excesso.
- Um exemplo de reação química muito comum em nosso cotidiano é a reação de combustão, para que ela ocorra é necessária a presença de três fatores: um combustível, um comburente e energia de ativação. Essa reação consiste na queima de um combustível que pode ser a gasolina, o álcool, etc., através da energia de ativação (calor de uma chama, faísca elétrica), na presença de um comburente que, em geral, é o oxigênio do ar (O2).
Uma reação química é uma transformação da matéria na qual ocorrem mudanças qualitativas na composição química de uma ou mais substâncias reagentes, resultando em um ou mais produtos. Envolve mudanças relacionadas à mudança nas conectividades entre os átomos ou íons, na geometria das moléculas das espécies reagentes ou ainda na interconversão entre dois tipos de isômeros. Para iniciar a reação, geralmente é necessário energia na forma de calor.
- Resumidamente, pode-se afirmar que uma reação química é uma transformação da matéria em que pelo menos uma ligação química é criada ou desfeita.
Características:
- Um aspecto importante sobre uma reação química é a conservação da massa e o número de espécies químicas microscópicas(átomos e íons) presentes antes e depois da ocorrência da reação.
Essas leis de conservação se manifestam microscopicamente sob a forma das leis de Lavoisier, do mestre Proust e de Dalton. De fato, essas leis, no modelo atômico de Dalton, se justificariam pelas leis de conservação acima explicitadas e pelo fato de os átomos apresentarem valências bem definidas. Ao conjunto das características e relações quantitativas dos números de espécies químicas presentes numa reação dá-se o nome de estequiometria.
- Deve-se salientar que uma ligação química ocorre devido a interações entre as nuvens eletrônicas dos átomos, e que então reação química apenas envolve mudanças nas eletrosferas. No caso de ocorrer mudanças nos núcleos atômicos teremos uma reação nuclear.
Ao passo que nas reações químicas a quantidade e os tipos de átomos sejam os mesmos nos reagentes e produtos, na reação nuclear, as partículas subatômicas são liberadas, o que causa redução de sua massa, sendo este um fato relacionado à existência de elementos isóbaros, isótonos e isótopos entre si.
Um exemplo de uma reação química é:
(ambos os regentes em solução aquosa):
NaCl + AgNO3 → NaNO3 + AgCl
Nesta reação química, ao passo que o NaNO3 permanece em solução, formou-se uma ligação entre a prata (Ag) e o cloro (Cl) o que resultou em um produto sólido de cloreto de prata (AgCl), pode-se então dizer que houve uma reação química.
Causas das reações químicas:
- O acontecimento de reações deve-se a fatores termodinâmicos e cinéticos.
Termodinâmico:
- Quanto à termodinâmica, o acontecimento de uma reação é favorecido com o aumento da entropia e a diminuição da energia. Essas duas grandezas se cooperam nesse caso de acordo com a seguinte equação: ΔG = ΔH - T.ΔS (para sistemas a pressão constante) ΔA = ΔU - T.ΔS (para sistemas a volume constante)
Onde T é a temperatura em kelvin, ΔH é a variação da entalpia (que é igual a energia absorvida ou liberada em pressão constante) entre os reagentes e os produtos, ΔU é variação da energia interna (que é igual a energia absorvida ou liberada a volume constante) entre eles, ΔS é a variação da entropia entre os mesmos, ΔG é uma grandeza chamada de energia livre de Gibbs e ΔA é uma grandeza chamada de energia de Helmholtz.
- Se ΔA e ΔG forem maiores que zero em dadas condições, a reação é dita como não espontânea nessas condições, e ela ocorre ou não ocorre em escala apreciável. Na situação de ΔA e ΔG iguais a zero teremos um equilíbrio químico.
Caso ΔA e ΔG sejam menores que zero em dadas condições, dizemos que a reação é termodinamicamente favorável nestas condições, ou seja, ela é espontânea. Contudo é importante notar que uma reação ser espontânea não necessariamente significa que ela ocorra rapidamente.
Cinética:
- Nesse ponto, entram os fatores cinéticos. Para que uma reação ocorra é necessário que antes, os reagentes superem uma certa barreira de energia, e quanto maior for essa barreira mais difícil será a reação ocorrer e mais lenta ela será.
Dessa forma, uma reação termodinamicamente favorável pode ocorrer de forma extremamente lenta ou acabar nem sendo observada em um intervalo de tempo consideravelmente grande; então se diz que a reação é cineticamente desfavorável.
- Um bom exemplo disso é o carvão e o diamante, que são duas formas diferentes de carbono (alótropos); em condições normais a transformação de diamante a carvão é termodinamicamente favorável porém cineticamente desfavorável, o que faz com que fossem necessários centenas ou milhares de anos para se observar alguma mudança em um diamante.
É preciso entender que uma reação para ser cineticamente viável, necessita primeiramente ser termodinamicamente possível.
Tipos de reações Químicas:
Tradicionalmente, as reações químicas podem ser classificadas de acordo com o número de reagentes e produtos em cada membro da equação química que representa a reação:
- Reações de síntese, composição ou adição
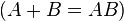 ;
; - Reações de análise ou decomposição
 ;
; - Reações de simples troca ou deslocamento (
 ;
; - Reações de dupla troca
 .
.
Outra classificação categoriza as reações em dois tipos:
- Reações de oxirredução ou
- Reações redox
- as demais reações
Algumas reações de síntese, algumas de análise, todas de simples troca e nenhuma de dupla troca são reações de oxirredução
- Um tipo de reação que não encontra paralelo nas classificações acima é a chamada reação de isomerização.
Ainda existem uma série de reações que são estudadas em Química Orgânica, ou seja, sub-classes de reações, tais como : Reações de Halogenação, Reações de Hidrogenação, Reações de Substituição Nucleofílica etc.

Reação Química
Mecanismo de reação:
- O mecanismo de reação é o conjunto das fases ou estados que constituem uma reação química, em outros termos é a sequência, etapa por etapa de reações elementares pela qual toda a reação química ocorre.
Os mecanismos de reação estão ligados à cinética química.
Conceitos básicos:
- Desde um ponto de vista termodinâmico, uma equação química, os reagentes são o estado inicial e os produtos o estado final, há uma variação de energia livre. A energia livre deve ser negativa já que será uma reação espontânea, ou seja, que a reação poderá levar-se a cabo sem nenhum impedimento termodinâmico.
Para tornar mais fácil a explicação será melhor fazê-lo com um exemplo:
∆G'= -
- Para fazer a ligação A-B, os reativos têm de encurtar as distâncias, mas isto aumenta a força de repulsão dos elétrons. Para evitar esta repulsão, os reativos terão que aproximar-se com suficiente energia cinética.
Acima desta energia, as moléculas A e B formam ligações e em correspondência, as moléculas B e C estão rompendo as suas. Neste momento há um complexo formado por A, B e C, chamado complexo ativado. Ao final todas as ligações de B e C serão rompidos e as ligações A e B serão formadas, ou seja, os produtos.
- Também há de se fazer menção à energia de ativação, que é a diferença entre a energia dos reativos e a do complexo ativado. Se pode considerar como uma barreira energética que deve passar os reativos para passar a ser produtos.
Tipos:
- Há dois tipos de mecanismo, dependendo do número de etapas que contém:
Reações elementares:
- Transcorre em somente uma etapa. Esta reação se produz com a formação de um só complexo ativado e só tem que superar uma barreira energética. Se representa em uma só equação química.
Reações complexas:
- Transcorre em duas ou mais etapas, com formação de intermediários. Também podemos dizer que é um conjunto de reações elementares, onde há mais de uma formação de complexos ativados diferentes e supera diferentes barreiras energéticas.
Se expressa em várias equações químicas ou uma global. Na equação química global, representa o estado inicial e o estado final do global das reações, mas não apresenta como tenha-se transcorrido a reação.
- Os intermediários são moléculas que aparecem no mecanismo da reação, mas não na equação inicial.
Molecularidade:
A molecularidade é o número de moléculas que tomam parte como reativos em uma reação elementar. Dependendo do número de moléculas que participam, se classificam:
- Unimoleculares: Só participa uma molécula.
- Bimoleculares: Participam 2 moléculas.
- Trimoleculares: Participam 3 moléculas (esta é muito rara).
Exemplo de Mecanismo:
Como exemplo consideramos a reação global entre o óxido nítrico e o oxigênio:
- Se sabe que os produtos não se formam diretamente como resultado da colisão de duas moléculas NO com uma molécula de O2 porque se tenha encontrado a espécie N2O2 durante o curso da reação. Um mecanismo possível é supor que a reação se dá em duas etapas ou reações elementares como as seguintes:
primeira etapa
segunda etapa
- Na primeira etapa duas moléculas de NO chocam-se para formar uma molécula de N2O2; é uma reação bimolecular. Depois, segue uma reação, entre o N2O2 e o O2 para formar duas moléculas de NO2; é uma reação bimolecular. A equação química global, que representa o câmbio total, se pode interpretar como a soma destas duas etapas.
As espécies como o N2O2 é o intermediário da reação.
Modelagem:
- Um correto mecanismo de reação é uma parte importante de precisão modelagem preditiva. Para muitos casos de combustão e sistemas de plasma, mecanismos detalhados não estão disponíveis ou ainda exigem desenvolvimento.
Mesmo quando a informação está disponível, identificando e organizando-se os dados relevantes de uma variedade de fontes, a conciliação entre valores discrepantes e a extrapolação à diferentes condições pode ser um processo difícil sem ajuda especializada.
Constantes de velocidade ou dados termoquímicos muitas vezes não estão disponíveis na literatura, técnicas de química computacional e/ou métodos de aditividade de grupos devem ser usado para obter os parâmetros necessários. Nas diferentes fases de elaboração de um mecanismo de reação, métodos apropriados devem ser utilizados.
Reação Química

